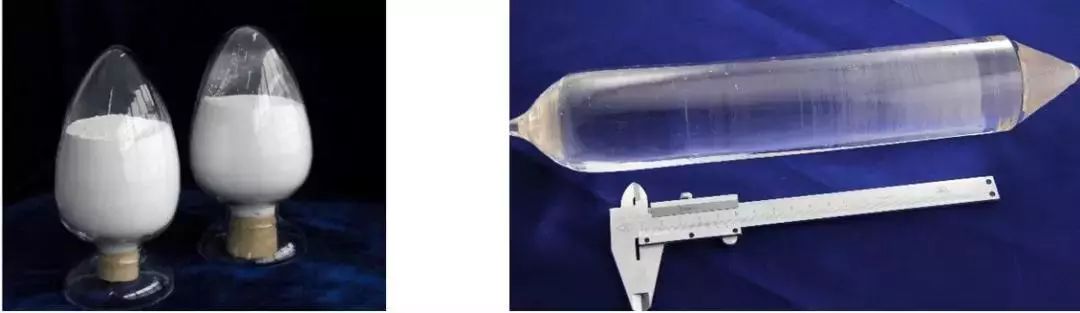
LutéciumC'est une terre rare dont le prix est élevé, les réserves sont minimes et les utilisations sont limitées. Elle est molle et soluble dans les acides dilués, et peut réagir lentement avec l'eau.
Les isotopes naturels comprennent 175Lu et une demi-vie de 2,1 × 10 ^ 10 ans Émetteur β 176Lu. Il est fabriqué en réduisant le fluorure de lutécium(III) LuF ∨ · 2H ₂ O avec du calcium.
L'utilisation principale est comme catalyseur pour les réactions de craquage du pétrole, d'alkylation, d'hydrogénation et de polymérisation ; De plus, le tantalate de lutétium peut également être utilisé comme matériau de poudre fluorescente aux rayons X ; le 177Lu, un radionucléide, peut être utilisé pour la radiothérapie des tumeurs.

À la découverte de l'histoire
Découvert par : G. Urban
Découvert en 1907
Le lutécium a été séparé de l'ytterbium par le chimiste français Ulban en 1907. C'était également une terre rare découverte et confirmée au début du XXe siècle. Le nom latin du lutécium vient de l'ancien nom de Paris, en France, ville natale d'Urban. La découverte du lutécium et d'une autre terre rare, l'europium, a complété la découverte de toutes les terres rares présentes dans la nature. Leur découverte peut être considérée comme ouvrant la quatrième voie à la découverte des terres rares et achevant la quatrième étape de la découverte des terres rares.
Configuration électronique
Arrangements électroniques :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1
Le lutécium est un métal blanc argenté, le plus dur et le plus dense des terres rares. Son point de fusion est de 1 663 °C, son point d'ébullition de 3 395 °C et sa densité de 9,8404. Il est relativement stable à l'air. L'oxyde de lutécium est un cristal incolore qui se dissout dans les acides pour former les sels incolores correspondants.
L'éclat métallique du lutétium, qui est celui d'une terre rare, se situe entre celui de l'argent et celui du fer. La teneur en impuretés a un impact significatif sur leurs propriétés, de sorte que leurs propriétés physiques sont souvent très différentes dans la littérature.
Les métaux yttrium, gadolinium et lutécium ont une forte résistance à la corrosion et peuvent conserver leur éclat métallique pendant longtemps.
Application
En raison des difficultés de production et des prix élevés, le lutécium a peu d'utilisations commerciales. Ses propriétés ne diffèrent pas significativement de celles des autres métaux lanthanides, mais ses réserves sont relativement plus faibles ; dans de nombreux endroits, d'autres métaux lanthanides sont donc généralement utilisés pour le remplacer.
Le lutécium peut être utilisé pour fabriquer des alliages spéciaux, comme l'alliage lutécium-aluminium, utilisé pour l'analyse par activation neutronique. Il peut également servir de catalyseur pour le craquage du pétrole, l'alkylation, l'hydrogénation et les réactions de polymérisation. De plus, le dopage au lutécium de certains cristaux laser, comme le grenat d'yttrium-aluminium, peut améliorer leurs performances laser et leur uniformité optique. Le lutécium peut également être utilisé pour les phosphores : le tantalate de lutécium est le matériau blanc le plus compact connu à ce jour et constitue un matériau idéal pour les phosphores X.
Le 177Lu est un radionucléide synthétique, qui peut être utilisé pour la radiothérapie des tumeurs.
Oxyde de lutéciumCristal de silicate de cérium yttrium lutécium dopé
Date de publication : 26 juin 2023