ScandiumLe scandium, de symbole Sc et de numéro atomique 21, est facilement soluble dans l'eau, peut interagir avec l'eau chaude et noircit facilement à l'air. Sa valence principale est +3. Il est souvent mélangé au gadolinium, à l'erbium et à d'autres éléments, avec un faible rendement et une teneur en croûte d'environ 0,0005 %. Le scandium est souvent utilisé pour la fabrication de verres spéciaux et d'alliages légers haute température.
Français À l'heure actuelle, les réserves prouvées de scandium dans le monde ne sont que de 2 millions de tonnes, dont 90 à 95 % sont contenues dans les minerais de bauxite, de phosphorite et de fer-titane, et une petite partie dans les minerais d'uranium, de thorium, de tungstène et de terres rares, principalement répartis en Russie, en Chine, au Tadjikistan, à Madagascar, en Norvège et dans d'autres pays. La Chine est très riche en ressources de scandium, avec d'énormes réserves minérales liées au scandium. Selon des statistiques incomplètes, les réserves de scandium en Chine sont d'environ 600 000 tonnes, qui sont contenues dans des gisements de bauxite et de phosphorite, des gisements de tungstène de filons de porphyre et de quartz dans le sud de la Chine, des gisements de terres rares dans le sud de la Chine, le gisement de minerai de fer de terres rares de Bayan Obo en Mongolie intérieure et le gisement de vanadium-titane-magnétite de Panzhihua au Sichuan.
En raison de la rareté du scandium, son prix est également très élevé ; à son apogée, il a été multiplié par dix par rapport à celui de l'or. Malgré sa baisse, son prix reste quatre fois supérieur à celui de l'or !
À la découverte de l'histoire
En 1869, Mendeleïev remarqua un écart de masse atomique entre le calcium (40) et le titane (48), et prédit l'existence d'un élément de masse atomique intermédiaire encore inconnu. Il prédit que son oxyde est X₂OÅ. Le scandium fut découvert en 1879 par Lars Frederik Nilson de l'Université d'Uppsala en Suède. Il l'exploita dans une mine d'or noir rare, un minerai complexe contenant huit types d'oxydes métalliques. Il en a extraitOxyde d'erbium (III)à partir de minerai d'or noir rare, et obtenuOxyde d'ytterbium(III)De cet oxyde, il existe un autre oxyde, d'un élément plus léger, dont le spectre indique qu'il s'agit d'un métal inconnu. Il s'agit du métal prédit par Mendeleïev, dont l'oxyde estSc₂O₃Le métal scandium lui-même a été produit à partir deChlorure de scandiumpar fusion électrolytique en 1937.
Mendeleïev
Configuration électronique
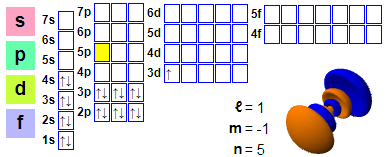
Configuration électronique : 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Le scandium est un métal de transition blanc argenté et mou avec un point de fusion de 1541 ℃ et un point d'ébullition de 2831 ℃.
Pendant une longue période après sa découverte, l'utilisation du scandium n'a pas été démontrée en raison de sa difficulté de production. Grâce à l'amélioration constante des méthodes de séparation des terres rares, un procédé éprouvé de purification des composés de scandium est désormais disponible. Le scandium étant moins alcalin que l'yttrium et les lanthanides, l'hydroxyde est le plus faible. Le minéral mixte contenant du scandium est donc séparé de l'élément de terre rare par précipitation par étapes, lorsque l'hydroxyde de scandium(III) est traité à l'ammoniac après son transfert en solution. L'autre méthode consiste à séparer le nitrate de scandium par décomposition polaire. Le nitrate de scandium étant le plus facile à décomposer, le scandium peut être séparé. De plus, la récupération complète du scandium présent dans les gisements d'uranium, de thorium, de tungstène, d'étain et autres minéraux constitue également une source importante de scandium.
Après avoir obtenu un composé de scandium pur, celui-ci est converti en ScCl Å et cofondu avec KCl et LiCl. Le zinc fondu sert de cathode pour l'électrolyse, provoquant la précipitation du scandium sur l'électrode de zinc. Le zinc est ensuite évaporé pour obtenir du scandium métallique. C'est un métal blanc argenté léger aux propriétés chimiques très actives, capable de réagir avec l'eau chaude pour produire de l'hydrogène. Le scandium métallique que vous voyez sur la photo est donc scellé dans une bouteille et protégé par de l'argon, faute de quoi il formera rapidement une couche d'oxyde jaune foncé ou grise, perdant ainsi son éclat métallique brillant.
Applications
Industrie de l'éclairage
Les utilisations du scandium sont concentrées dans des directions très lumineuses, et il n'est pas exagéré de le surnommer le Fils de la Lumière. La première arme magique du scandium est la lampe au scandium-sodium, qui peut éclairer des milliers de foyers. Il s'agit d'une lampe électrique aux halogénures métalliques : l'ampoule est remplie d'iodure de sodium et de triiodure de scandium, et des feuilles de scandium et de sodium sont ajoutées simultanément. Lors d'une décharge haute tension, les ions scandium et sodium émettent respectivement de la lumière à leurs longueurs d'onde d'émission caractéristiques. Les raies spectrales du sodium sont de 589,0 et 589,6 nm, deux célèbres lumières jaunes, tandis que celles du scandium sont de 361,3 à 424,7 nm, une série d'émissions de lumière proche ultraviolette et bleue. Grâce à leur complémentarité, la couleur globale de la lumière produite est la lumière blanche. C'est précisément grâce à leur rendement lumineux élevé, leur belle couleur de lumière, leurs économies d'énergie, leur longue durée de vie et leur excellente capacité antibuée que les lampes au scandium sodium sont largement utilisées pour l'éclairage des caméras de télévision, des places, des stades et des routes, et sont considérées comme des sources lumineuses de troisième génération. En Chine, ce type de lampe est progressivement promu comme une nouvelle technologie, tandis que dans certains pays développés, il était largement utilisé dès le début des années 1980.
La deuxième arme magique du scandium réside dans les cellules solaires photovoltaïques, capables de capter la lumière diffusée au sol et de la transformer en électricité pour alimenter la société humaine. Le scandium est le métal barrière le plus performant pour les cellules solaires en silicium métal-isolant et semi-conducteur.
Sa troisième arme magique est la source de rayons gamma A. Cette arme magique peut briller intensément par elle-même, mais ce type de lumière est invisible à l'œil nu : il s'agit d'un flux de photons de haute énergie. On extrait généralement le 45Sc des minéraux, seul isotope naturel du scandium. Chaque noyau de 45Sc contient 21 protons et 24 neutrons. Le 46Sc, un isotope radioactif artificiel, peut être utilisé comme source de rayonnement gamma ou comme atome traceur pour la radiothérapie des tumeurs malignes. Il existe également des applications comme le laser à grenat d'yttrium-gallium-scandium.Fluorure de scandiumFibre optique infrarouge en verre et tube cathodique à revêtement de scandium sur les téléviseurs. Il semble que le scandium soit né avec la luminosité.
Industrie des alliages
Le scandium sous sa forme élémentaire est largement utilisé pour le dopage des alliages d'aluminium. L'ajout de quelques millièmes de scandium à l'aluminium entraîne la formation d'une nouvelle phase Al3Sc, qui joue un rôle de métamorphisme dans l'alliage d'aluminium et modifie significativement sa structure et ses propriétés. L'ajout de 0,2 à 0,4 % de Sc (soit une proportion très similaire à celle du sel ajouté aux légumes sautés à la maison, une petite quantité suffit) peut augmenter la température de recristallisation de l'alliage de 150 à 200 °C et améliorer significativement sa résistance à haute température, sa stabilité structurelle, ses performances de soudage et sa résistance à la corrosion. Il permet également d'éviter la fragilisation, fréquente lors d'un travail prolongé à haute température. L'alliage d'aluminium à haute résistance et haute ténacité, le nouvel alliage d'aluminium soudable résistant à la corrosion à haute résistance, le nouvel alliage d'aluminium à haute température, l'alliage d'aluminium à haute résistance résistant à l'irradiation neutronique, etc., ont des perspectives de développement très intéressantes dans l'aérospatiale, l'aviation, les navires, les réacteurs nucléaires, les véhicules légers et les trains à grande vitesse.
Le scandium est également un excellent modificateur du fer, et une petite quantité de scandium peut améliorer considérablement la résistance et la dureté de la fonte. Il peut également être utilisé comme additif dans les alliages de tungstène et de chrome haute température. Outre la confection de robes de mariée, le scandium possède un point de fusion élevé et une densité similaire à celle de l'aluminium. Il est également utilisé dans les alliages légers à point de fusion élevé, tels que les alliages de scandium-titane et de scandium-magnésium. Cependant, en raison de son prix élevé, il est généralement réservé aux industries manufacturières haut de gamme, comme les navettes spatiales et les fusées.
Matériau céramique
Le scandium, une substance unique, est généralement utilisé dans les alliages, et ses oxydes jouent un rôle important dans les matériaux céramiques. La céramique de zircone tétragonale, utilisable comme matériau d'électrode pour les piles à combustible à oxyde solide, possède une propriété unique : la conductivité de cet électrolyte augmente avec la température et la concentration en oxygène de l'environnement. Cependant, la structure cristalline de cette céramique ne peut être stable et n'a aucune valeur industrielle. Il est nécessaire de doper certaines substances capables de fixer cette structure afin de conserver ses propriétés d'origine. L'ajout de 6 à 10 % d'oxyde de scandium équivaut à une structure en béton, permettant ainsi de stabiliser la zircone sur un réseau carré.
Il existe également des matériaux céramiques techniques tels que le nitrure de silicium à haute résistance et résistant aux hautes températures comme densificateurs et stabilisateurs.
En tant que densificateur,Oxyde de scandiumIl peut former une phase réfractaire Sc2Si2O7 au bord des particules fines, réduisant ainsi la déformation à haute température des céramiques techniques. Comparé à d'autres oxydes, il améliore davantage les propriétés mécaniques à haute température du nitrure de silicium.
Chimie catalytique
En génie chimique, le scandium est souvent utilisé comme catalyseur, tandis que le Sc2O3 peut être utilisé pour la déshydratation et la désoxydation de l'éthanol ou de l'isopropanol, la décomposition de l'acide acétique et la production d'éthylène à partir de CO et de H2. Le catalyseur PtAl contenant du Sc2O3 est également un catalyseur important pour les procédés d'hydrogénation, de purification et de raffinage du pétrole lourd dans l'industrie pétrochimique. Dans les réactions de craquage catalytique telles que le cumène, l'activité du catalyseur zéolithique Sc-Y est 1 000 fois supérieure à celle du catalyseur au silicate d'aluminium ; par rapport à certains catalyseurs traditionnels, les catalyseurs au scandium offrent de très belles perspectives de développement.
Industrie de l'énergie nucléaire
L'ajout d'une petite quantité de Sc2O3 à UO2 dans le combustible nucléaire d'un réacteur à haute température peut éviter la transformation du réseau, l'augmentation du volume et la fissuration causées par la conversion de UO2 en U3O8.
Pile à combustible
De même, l’ajout de 2,5 % à 25 % de scandium aux batteries nickel-alcali augmentera leur durée de vie.
Élevage agricole
En agriculture, des semences telles que le maïs, la betterave, le pois, le blé et le tournesol peuvent être traitées au sulfate de scandium (la concentration est généralement de 10-3 à 10-8 mol/L, la concentration variant selon les plantes), et l'effet germinatif réel a été observé. Après 8 heures, le poids sec des racines et des bourgeons a augmenté respectivement de 37 % et 78 % par rapport aux semis, mais le mécanisme est encore à l'étude.
Depuis l'attention de Nielsen sur la dette des données de masse atomique jusqu'à aujourd'hui, le scandium n'est entré dans la mémoire collective que depuis une centaine ou une vingtaine d'années, mais il est resté pratiquement sur le banc d'essai pendant un siècle. Ce n'est qu'avec le développement fulgurant de la science des matériaux à la fin du siècle dernier qu'il lui a apporté sa vitalité. Aujourd'hui, les terres rares, dont le scandium, sont devenus des éléments incontournables de la science des matériaux, jouant des rôles en constante évolution dans des milliers de systèmes, améliorant notre quotidien et créant une valeur économique encore plus difficile à mesurer.
Date de publication : 29 juin 2023